

主动脉夹层(aortic dissection,AD)是指由于各种原因导致的主动脉内膜、中膜撕裂,血液通过主动脉内膜裂口进入主动脉壁,造成动脉壁的分离,同时血流逆行或顺行冲击导致主动脉壁间血肿蔓延,使得主动脉被分割为真腔和假腔,并通过一个或数个破口与主动脉原有正常管腔相交通,从而形成“夹层”1。
AD是最常见的主动脉疾病之一。AD发病与季节存在相关性,冬春季节发病率较高,夏季发病率较低。我国AD发病率约为2.8/10万人年,男性明显高于女性(3.7/10万 人年vs 1.5/10万人年)。Sino-RAD研究显示我国AD患者平均年龄51岁,比欧美国家相比平均年轻10岁以上,血压控制不理想可能是我国AD发病较早的重要原因。近年来我国AD患病率呈现上升趋势2-4。
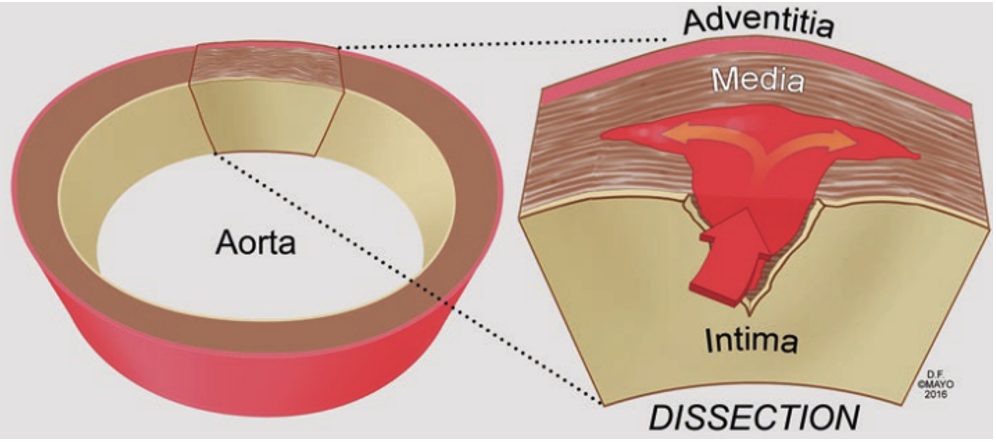
图示:典型主动脉夹层形成机制5
AD起病凶险,典型症状为前胸、后背或腹部突发性剧烈的撕裂样或刀割样锐痛,疼痛持续难以忍受。疼痛可沿大动脉走行方向传导和转移至腹部或下腹部。 88.1%的AD患者有疼痛症状,70.3%的患者为突发疼痛。随病程进展,患者还可出现与主动脉破裂、主动脉瓣关闭不全、重要组织脏器缺血相关的症状和体征。AD引起患者死亡的主要原因是主动脉破裂、急性心包压塞、急性心肌梗死、卒中、腹腔脏器缺血、肢体缺血等。未经治疗的急性夹层6小时内死亡率超过22.7%,24小时内超过50%,一周内超过68%。未经手术治疗的急性Stanford A型AD发病24 h内病死率每小时增加1%~2%,发病1周病死率超过70%。即使是慢性AD仍存在主动脉破裂、脏器衰竭等死亡风险1, 3。
内膜撕裂起源于升主动脉(承受应力最大处)者占65% ,起于降主动脉者占 25%,起于主动脉弓和腹主动脉的占 10%。根据内膜撕裂的位置和夹层沿主动脉延展的范围可对主动脉夹层进行解剖分型,主要有DeBakey分型和Stanford分型两种。DeBakey分型分为3型:I型夹层起于升主动脉,并累及主动脉弓,延伸至胸降主动脉或腹主动脉;II型夹层起于并局限于升主动脉;III a型夹层起于并局限于胸降主动脉; IIIb型夹层累及胸降主动脉和腹主动脉。 Stanford分型简化了解剖分类标准,只依据第一破口的起始部位来分类:Stanford A型夹层起于升主动脉,因此包括DeBakey I型和II型夹层;Stanford B型夹层起于左锁骨下以远的降主动脉,包括DeBakey IIIa型和IIIb型1, 3。

图示:主动脉夹层的DeBakey分型与Standford分型对照6
主动脉瘤(aortic aneurysm)是指由于各种原因造成胸主动脉壁正常结构的损害,在血流压力的作用下,主动脉局部或弥漫性扩张或膨出,达到正常主动脉直径的1.5倍以上,即成为主动脉瘤。特别的,腹主动脉直径超过30mm即可诊断为腹主动脉瘤。胸主动脉瘤发病率约为5~10/万人年,腹主动脉瘤发病率约为50/万人年7, 8。
大多数主动脉瘤患者没有明显症状。对于有明显临床症状的患者,胸部、腹部疼痛是最常见的主诉。其他非特异性的临床症状多由瘤体压迫、牵拉、侵蚀周围组织所引起。当主动脉瘤破裂时,出血速度和出血量非常大,可出现急性胸痛、腹痛、休克等症状和体征,死亡率高达90%1, 9, 10。
根据动脉瘤累及部位不同,可将主动脉瘤分为胸主动脉瘤(thoracic aortic aneurysm, TAA)、腹主动脉瘤(abdominal aortic aneurysm,AAA)和胸腹主动脉瘤(thoracoabdominal aortic aneurysm, TAAA):
TAA可根据动脉瘤位置大致划分为主动脉根部瘤、升主动脉瘤、主动脉弓瘤和降胸主动脉瘤,而降主动脉瘤以第6肋为界又可进一步分为A、B、C三型11, 12;

图示:胸主动脉瘤分型11
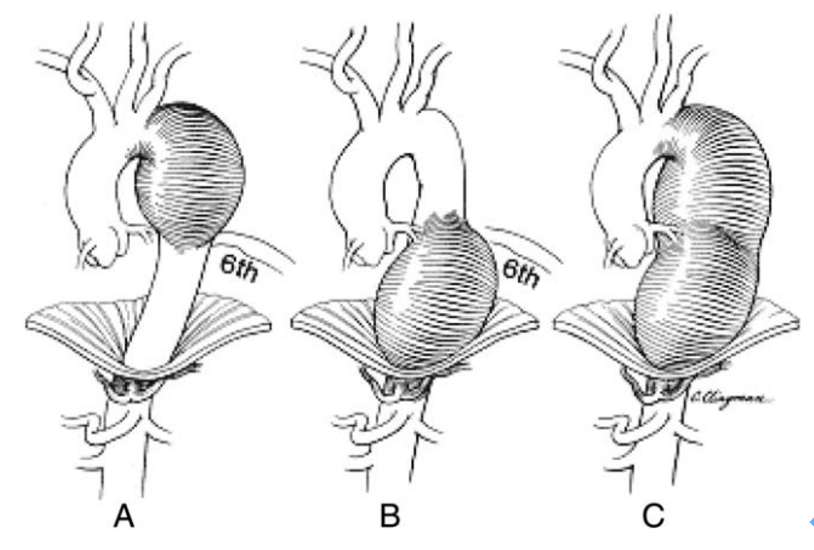
图示:降胸主动脉瘤分型12
AAA根据瘤体与肾动脉和内脏动脉的解剖关系可分为肾动脉下型、近肾动脉型、肾动脉累及型和腹腔干累及型13;
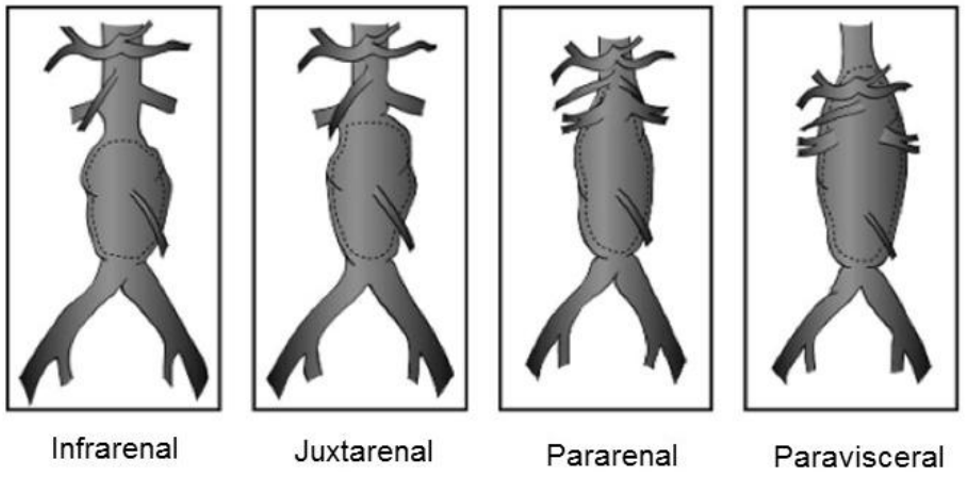
图示:腹主动脉瘤分型13
TAAA的改良Crawford分型共有5型,I型瘤体位于左锁骨下动脉与腹腔干之间(即降主动脉瘤),II型上界位于左锁骨下动脉与第六肋间之间、下界超过肾动脉平面,III型上界低于第六肋间、下界超过肾动脉平面,IV型累计腹主动脉全程,V型位于第六肋间与肾动脉平面之间14。
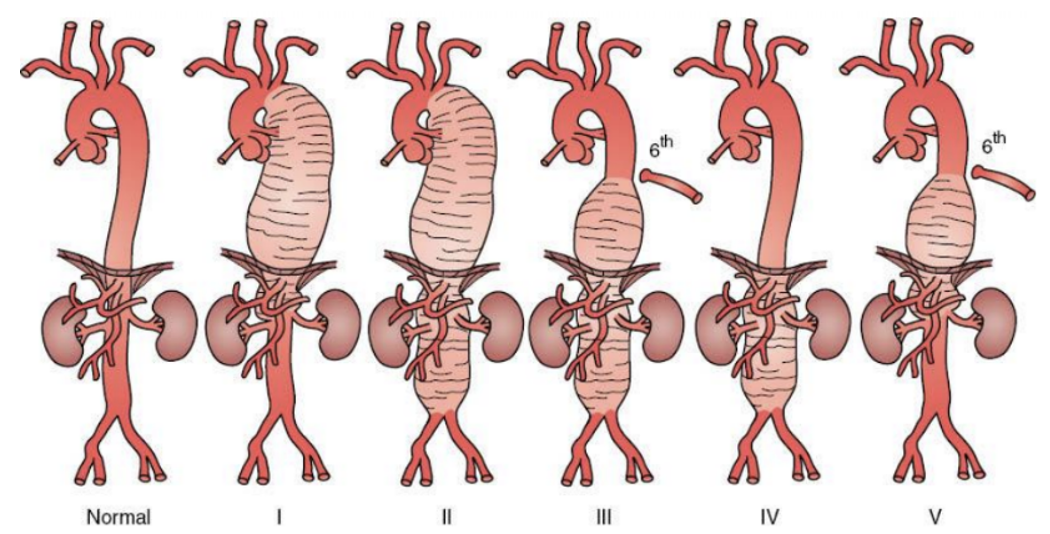
图示:胸腹主动脉瘤的Safi改良Crawford分型13
需要注意的是,胸主动脉瘤和腹主动脉瘤实际上是一组密切相关的疾病,27%的腹主动脉瘤患者同时患有胸主动脉瘤10。
主动脉腔内修复(endovascular aortic repair,EVAR)起源于上世纪90年代,其原理是经过股动脉,将覆膜支架输送到主动脉病变处,以隔绝动脉瘤瘤体或隔绝主动脉夹层的破口同时扩张真腔压迫假腔,从而防止疾病进展4。随着技术创新和产品迭代,EVAR已经成为主动脉疾病的重要治疗措施。与传统外科手术相比,EVAR具有创伤小 、成功率高、恢复快,并发症少等优点。
主动脉腔内修复常用于Stanford B型夹层、降胸主动脉瘤、解剖结构合适的腹主动脉瘤、主动脉壁间血肿、主动脉穿通性溃疡、主动脉创伤、主动脉包裹性破裂、主动脉假性动脉瘤和主动脉医源性夹层等。ESC指南对伴有并发症和不伴并发症的Stanford B型夹层腔内修复推荐等级分别为I C和IIa B;对于降胸主动脉瘤,腔内修复的推荐等级IIa C;对于解剖结构适宜的腹主动脉瘤,腔内修复推荐等级为I A10。目前我国Stanford B型夹层EVAR治疗率已达69.6%,手术成功率高达99.1%,且死亡率仅为2.5%,明显低于外科手术治疗(8.0%)和单纯药物治疗(9.8%)15, 16。
然而,对于Stanford A型夹层全腔内修复、主动脉根部和弓部胸主动脉瘤、广泛累及内脏动脉、髂分支的腹主动脉瘤,现有EVAR器械和技术仍有很大提升空间,其中存在巨大的未满足临床需求。
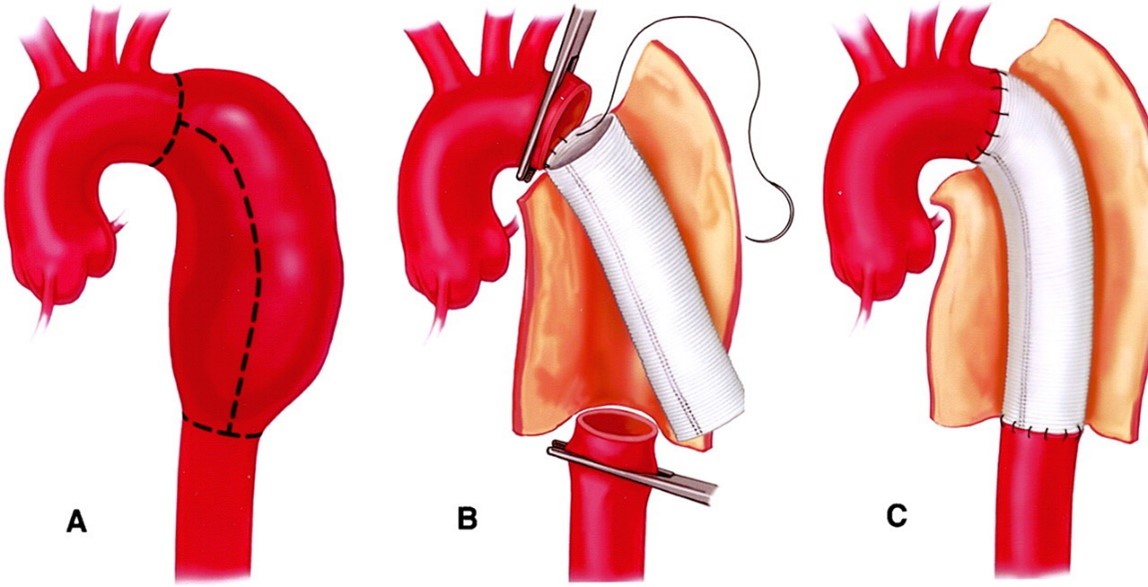
图示:主动脉外科手术示意图(以降胸主动脉瘤为例)17
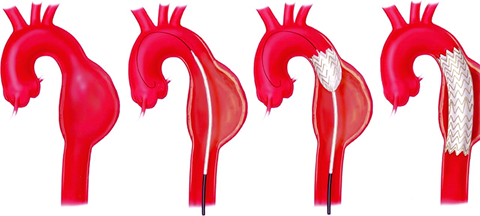
图示:EVAR示意图(以降胸主动脉瘤为例)17
下肢动脉疾病(lower extremity arterial disease,LEAD)属于外周动脉疾病(Peripheral arterial)PAD中的一种。广义的LEAD应包括全部引起下肢动脉病变、引起下肢血流障碍的疾病,病因可包括下肢动脉瘤、下肢动脉栓塞、下肢动脉血栓闭塞性脉管炎、动脉囊性外膜病和下肢动脉硬化闭塞等。狭义的LEAD仅指下肢动脉硬化性闭塞(arteriosclerosis obliterans, ASO)引起的下肢动脉疾病18。我国≥ 35 岁的自然人群LEAD患病率为 6.6%,患病率随年龄增长而上升,70 岁以上人群的患病率在 15%~20%。男性发病率略高于女性。推测我国下肢动脉疾病患者约为4530万。我国下肢动脉疾病的主要危险因素有吸烟、高血压、高胆固醇血症和 2 型糖尿病等,其中吸烟与LEAD相关性最强,吸烟者患病风险约为正常人的2.6倍19。不同危险因素对应的LEAD病变好发部位存在差异20。
LEAD的典型病理改变是动脉粥样硬化斑块形成、内膜及中层增生、动脉硬化,继而使得动脉管腔狭窄甚至闭塞,导致远端肢体血供不足,如不经治疗,5~10%的患者5年内可进展为(Critical limb ischemia,CLI)21。CLI患者仍不及时治疗,1年截肢率高达22%21。
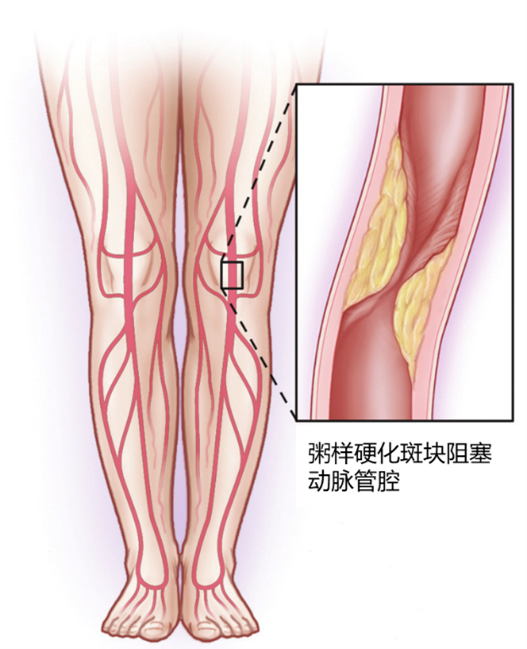
图示:动脉管腔狭窄23
LEAD临床表现多样。典型临床表现为间歇性跛行和静息痛,典型体征主要有肢端皮温下降、皮肤菲薄、毛发脱落 等营养障碍性改变,下肢动脉搏动减弱或消失,动脉收缩压下降,肢体溃疡、坏疽等。其中,间歇性跛行是指一种由运动诱发的症状,指下肢运动后产生的疲乏、疼痛或痉挛,常发生在小腿后方,导致行走受限,短时间休息后(常少于10 min)疼痛和不适感可缓解;再次运动后症状又出现。跛行距离可以提示缺血的程度;静息痛是指患肢即使不运动,在静息状态下也可出现的持续性疼痛,是LEAD引起肢体严重缺血的主要临床表现之一,预示肢体存在近期缺血坏死风险24。
LEAD是全身动脉硬化的一种表征,因此生活方式干预和药物治疗是LEAD治疗的基础。生活方式干预主要包括戒烟、健康饮食和监督运动疗法。药物治疗方案主要涵盖高脂血症、高血压、糖尿病等基础疾病的药物治疗以及抗血小板、抗凝药物治疗,此外β受体抑制剂、钙离子通道抑制剂、PDE III抑制剂、前列腺素、5-HT2受体拮抗剂可改善运动功能和间歇性跛行症状。
当药物治疗无法改善患者症状和运动功能时,需要选择下肢动脉血运重建治疗。我国约 1.9%的患者接受了血运重建,据此估测实施血运重建的例数大约为 86 万。血运重建治疗主要可分为介入治疗和外科手术治疗两种方式。介入治疗因其良好的安全性和有效性逐渐成为LEAD的主流治疗方式。对于动脉病变范围<5cm的主-髂动脉LEAD、<25cm的股-腘动脉LEAD,介入治疗是首选的血运重建治疗方式18, 24, 25。
LEAD介入治疗方式包括球囊成型、支架植入、斑块切除、切割球囊、药涂球囊、冷冻球囊、导管溶栓和机械取栓等。目前,支架植入和球囊扩张成形是治疗下肢动脉狭窄的主要介入治疗方式。随着新技术的涌现,LEAD介入治疗率有望持续提高。
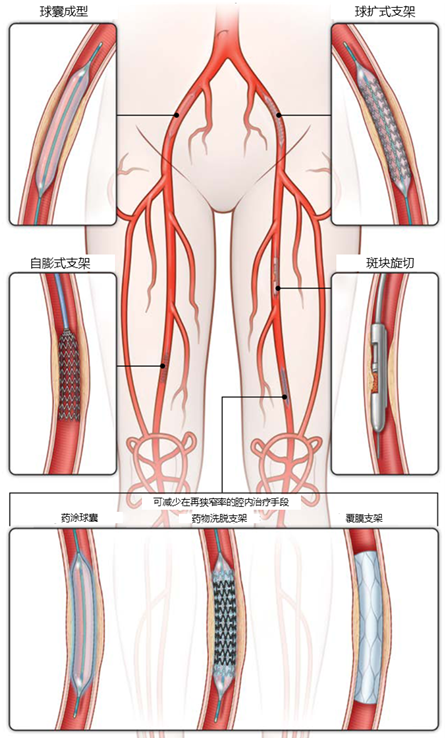
图示:LEAD介入治疗示意图26
参考文献:
1. 赵宗继陈孝平汪建平. 外科学(第9版): 人民卫生出版社; 2018.
2. 胡盛寿. 中国心血管健康与疾病报告2019: 科学出版社; 2020.
3. 中国医师协会心血管外科分会大血管外科专业委员会. 主动脉夹层诊断与治疗规范中国专家共识. 中华胸心血管外科杂志 2017;33:641-54.
4. 中国医师协会心血管外科分会大血管外科专业委员会. 急性主动脉综合征诊断与治疗规范中国专家共识(2021版). 中华胸心血管外科杂志 2021;37:257-69.
5. Oderich GS. Endovascular Aortic Repair: Springer; 2017.
6. Tadros RO, Tang GHL, Barnes HJ, et al. Optimal Treatment of Uncomplicated Type B Aortic Dissection JACC Review Topic of the Week. J AM COLL CARDIOL 2019;74:1494-504.
7. Zommorodi S, Leander K, Roy J, Steuer J, Hultgren R. Understanding abdominal aortic aneurysm epidemiology: socioeconomic position affects outcome. J Epidemiol Community Health 2018;72:904-10.
8. Bossone E, Eagle KA. Epidemiology and management of aortic disease: aortic aneurysms and acute aortic syndromes. NAT REV CARDIOL 2021;18:331-48.
9. 中华医学会外科学分会血管外科学组. 腹主动脉瘤诊断与治疗指南. 中国实用外科杂志 2008;28:916-8.
10. Erbel R, Aboyans V, Boileau C, et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases: Document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult. The Task Force for the Diagnosis and Treatment of Aortic Diseases of the European Society of Cardiology (ESC). EUR HEART J 2014;35:2873-926.
11. Disease. SGSI. AORTIC ANEURYSM. In.
12. Estrera AL, Rubenstein FS, Miller CR, Huynh TT, Letsou GV, Safi HJ. Descending thoracic aortic aneurysm: surgical approach and treatment using the adjuncts cerebrospinal fluid drainage and distal aortic perfusion. ANN THORAC SURG 2001;72:481-6.
13. Calero A, Illig KA. Overview of aortic aneurysm management in the endovascular era. SEMIN VASC SURG 2016;29:3-17.
14. Safi HJ, Winnerkvist A, Miller CR, et al. Effect of extended cross-clamp time during thoracoabdominal aortic aneurysm repair. ANN THORAC SURG 1998;66:1204-9.
15. Xiong J, Chen C, Wu Z, Chen D, Guo W. Recent evolution in use and effectiveness in mainland China of thoracic endovascular aortic repair of type B aortic dissection. Sci Rep 2017;7:17350.
16. Wang W, Duan W, Xue Y, et al. Clinical features of acute aortic dissection from the Registry of Aortic Dissection in China. J Thorac Cardiovasc Surg 2014;148:2995-3000.
17. Isselbacher EM. Thoracic and abdominal aortic aneurysms. CIRCULATION 2005;111:816-28.
18. Aboyans V, Ricco J, Bartelink MEL, et al. 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS). EUR HEART J 2018;39:763.
19. 胡盛寿. 中国心血管健康与疾病报告2019: 科学出版社; 2020.
20. Diehm N, Shang A, Silvestro A, et al. Association of cardiovascular risk factors with pattern of lower limb atherosclerosis in 2659 patients undergoing angioplasty. EUR J VASC ENDOVASC 2006;31:59-63.
21. Norgren L, Hiatt WR, Dormandy JA, et al. Inter-society consensus for the management of peripheral arterial disease (TASC II). J VASC SURG 2007;45S:S5-67.
22. Abu Dabrh AM, Steffen MW, Undavalli C, et al. The natural history of untreated severe or critical limb ischemia. J VASC SURG 2015;62:1642.
23. Surgery SFV. Peripheral Arterial Disease. In; 2018.
24. 中华医学会外科学分会血管外科学组. 下肢动脉硬化闭塞症诊治指南. 中华普通外科学文献(电子版) 2016;10:1-18.25. Gerhard-Herman MD, Gornik HL, Barrett C, et al. 2016 AHA/ACC Guideline on the Management of Patients With Lower Extremity Peripheral Artery Disease: Executive Summary A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. CIRCULATION 2017;135:E686-725.
26. Kullo IJ, Rooke TW. Peripheral Artery Disease. NEW ENGL J MED 2016;374:861-71.